武汉普诺赛生命科技有限公司品牌商
13 年
手机商铺
- NaN
- 0.7000000000000002
- 0.7000000000000002
- 2.7
- 2.7
公司新闻/正文
解锁间充质干细胞:从临床探索到机制剖析,治疗研究现状全景解读
1388 人阅读发布时间:2025-11-13 09:19
间充质干细胞(Mesenchymal Stem Cells,MSCs)是一群成体干细胞,凭借独特的生物学特性和治疗潜能,已成为疾病研究领域的“新星”。截止至2024年5月,全球范围内基于MSCs的在研临床试验已超过1,200项,且已有超过27种MSCs相关的产品获批,其临床应用价值已得到初步验证。
为帮助大家快速、系统地掌握MSCs关键知识,小普规划了一系列推文,依次介绍:MSCs概述、体外培养与扩增、三系分化和细胞治疗。本期细胞学堂聚焦于MSCs在细胞治疗中的应用,带您深入了解其核心机制及研究现状。
往期回顾
一、治疗优势
干细胞治疗是再生医学领域最具前景的研究方向之一。其核心原理是利用干细胞的分化潜能和自我更新能力,修复或替代体内受损的组织与细胞,从而实现疾病治疗。
在多种干细胞类型中,胚胎干细胞(ESCs)、诱导多能干细胞(iPSCs)和间充质干细胞(MSCs)是目前研究和应用最广泛的三类。与前两者相比,MSCs具有以下优势:
1. 安全性高:ESCs和iPSCs具有向成体内所有细胞类型分化的潜能,因此在体内移植时可能形成畸胎瘤。而MSCs为成体干细胞,其分化潜能相对有限,主要分化为特定类型的细胞(如骨细胞、软骨细胞、脂肪细胞等),肿瘤形成风险较低。
2. 免疫原性低:MSCs表达低水平MHC分子(MHC是免疫系统识别“自我”与“非自我”的关键分子),因此在异体移植中较少激活免疫排斥反应。
3. 伦理争议少:MSCs可从脐带、脂肪、骨髓等成体组织中获得,不涉及胚胎来源,因此伦理争议远低于ESCs。
4. 获取与扩增便利:MSCs来源广泛、获取过程相对安全且侵入性低(如脐带或脂肪组织)。在体外条件下可稳定扩增,易于建立可用于临床的大规模细胞库。
正因如此,MSCs在基因工程和疾病治疗领域展现出了广阔的应用前景,并逐渐成为临床研究与产品开发的热点方向(表1)。
表1. 获批间充质干细胞产品(部分)
| 药品名称 | 细胞类型 | 适应症 | 获批地点/时间 |
| 艾米迈托赛 | 脐带MSCs | 激素治疗失败的急性移植物抗宿主病(aGVHD) | 中国(2025) |
| Ryoncil | 异体骨髓MSCs | 类固醇难治性急性移植物抗宿主病 | 美国(2024) |
| Alofisel | 异体脂肪MSCs | 复杂性肛周瘘(复杂性肛周瘘) | 欧洲(2018)/日本(2021) |
| Stemirac | 自体骨髓MSCs | 脊髓损伤 | 日本(2018) |
| Stempeucel | 异体骨髓MSCs | 血栓闭塞性动脉炎引起的严重肢体缺血 | 印度(2016) |
| TEmcell | 异体骨髓MSCs | 急性移植物抗宿主病(aGVHD) | 日本(2015) |
| NeuroNATA-R | 自体骨髓MSCs | 萎缩侧索硬化症 | 韩国(2014) |
| Cartistem | 脐血MSCs | 由变性或重复创伤引起的膝关节软骨缺损 | 韩国(2012) |
| Cuepistem | 自体脂肪MSCs | 复杂性克罗恩病并发肛痿 | 韩国(2012) |
| Prochymal | 异体骨髓MSCs | 急性移植物抗宿主病 | 美国、加拿大、新西兰(2012) |
| Cellgram-AMI | 自体骨髓MSCs | 急性心肌梗死 | 韩国(2011) |
| Queencell | 自体脂肪MSCs | 皮下组织缺损 | 韩国(2010) |
二、作用机制
MSCs的治疗效应是通过多种复杂机制共同发挥效应的,主要机制有:
1. 免疫调节机制
MSCs通过旁分泌、细胞间接触、代谢调控等多种途经调控先天和适应性免疫反应。
-
旁分泌作用:MSCs分泌多种免疫调节因子,包括细胞因子、生长因子、趋化因子和酶等。这些因子既能通过协同或拮抗作用调节微环境,又能直接作用于T细胞、巨噬细胞等免疫细胞,调节免疫反应、抑制炎症并促进组织修复。
-
细胞间接触:MSCs通过PD-L1、FasL、 ICAM-1等分子与T细胞、B细胞、树突状细胞(DCs)、自然杀伤细胞(NK细胞)、中性粒细胞和巨噬细胞等免疫细胞相互作用,抑制免疫细胞增殖或诱导其凋亡。
-
代谢调控:MSCs通过代谢途径产生色氨酸代谢酶(IDO)和前列腺素 E2(PGE2)等,调节免疫细胞功能。
2. 外囊泡及外泌体调控
MSCs通过释放细胞外囊泡(MSCs-EV)传递蛋白质、mRNA、miRNA等生物活性分子。EV主要包括外泌体(30-120 nm)、微泡(MV)(100-1,000 nm)和凋亡小体,其中外泌体是主要的功能执行者:
-
免疫调节:外泌体可抑制炎症因子释放,通过miRNA、蛋白质或受体介导的胞吞作用调节T细胞、巨噬细胞和NK细胞等免疫细胞活性。
-
信号通路调节:外泌体可激活或抑制免疫相关信号通路,如NF-κB、STAT3和PI3K/AKT,从而介导免疫调节和组织修复。
-
物质运输:外泌体将miRNA或其他生物活性物质传递至靶细胞,发挥免疫调节作用。
微泡和凋亡小体也参与细胞间信号传递,协同调控局部微环境。
3. 归巢与定向机制
除了分子水平的调控外,MSCs还具备物理迁移能力,能够感应受损组织释放的趋化信号,通过血流迁移并穿越血管壁,最终“归巢”至受损部位。归巢包括五个步骤:滚动、激活、牢固附着、爬行、跨内皮迁移(图1)。提高MSCs的归巢效率是其治疗中的一个重要挑战。
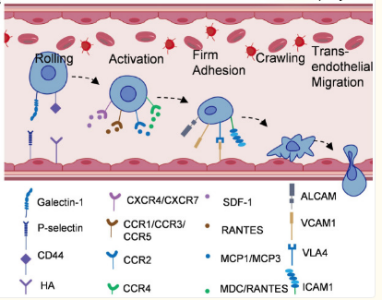
图1. 间充质干细胞归巢机制的示意图。(图片来自文献1)
三、应用方向
间充质干细胞(MSCs)及其衍生物具有良好的生物相容性、靶向迁移能力和免疫调节特性,为构建高效、安全的药物递送系统提供了多样策略。主要应用方向包括:
1. 工程化MSCs
通过基因修饰或外源药物负载,实现治疗分子定向递送。在胰腺导管腺癌、白血病、神经母细胞瘤等肿瘤,以及肝纤维化等疾病模型中表现出良好的靶向性和治疗效果。
2. MSCs衍生的细胞外囊泡(EVs)
MSCs分泌的外泌体及微囊泡可作为无细胞药物递送载体,通过负载miRNA、mRNA或小分子药物,在癌症、骨关节炎、脑缺血再灌注损伤和炎症性疾病等领域展现出显著的治疗潜力。
3. MSCs-生物材料复合体系
MSCs与水凝胶、支架材料或可降解聚合物等功能性材料结合,可增强细胞存活率和局部滞留时间,促进骨缺损修复、肢体再生及牙周组织再生等组织工程应用。
4. MSCs膜包覆纳米颗粒系统
将纳米颗粒表面包覆MSC细胞膜,融合其靶向归巢与免疫逃逸特性,并结合纳米材料的可控释放与高负载能力,在原位胶质瘤、免疫性疾病和心肌损伤修复等研究中显示出优越的治疗前景。
四、挑战展望
尽管MSCs在多种疾病治疗中展现了良好的应用前景,但仍面临诸多挑战:
1. 体内外结果差异:MSCs的体外实验结果与体内表现往往存在差异,尤其在由体外向体内转化时,MSCs的免疫原性、归巢能力和存活时间可能发生变化,这对治疗效果的稳定性构成挑战。
2. 疗效与安全性不确定性:目前多数临床研究证实MSCs治疗总体安全,但其疗效仍受患者个体差异、疾病类型及细胞来源等多因素影响,长期疗效仍需大规模验证。
3. 免疫排斥与潜在肿瘤风险:尽管MSCs具有低免疫原性,但在特定微环境中仍可能诱发免疫反应,甚至促进肿瘤细胞生长,需在长期研究中严格评估其安全性。
MSCs作为一种具有多向分化潜能和免疫调节作用的种子细胞,正在从实验室研究逐步迈向临床应用。随着标准化制备体系的建立、工程化改造技术的发展以及无细胞疗法的兴起,MSCs有望在再生医学、免疫治疗及组织修复等领域实现更广泛、更精准的临床转化。
以上是间充质干细胞用于细胞治疗的全部内容,包括前述三期间充质干细胞系列推文在内,我们从概述出发,陆续讲解了体外培养与扩增、三系分化及细胞治疗,带大家完整梳理了MSCs从基础到应用的关键知识~
更多细胞培养干货,请持续关注细胞学堂专栏~
相关产品推荐:
| 产品货号 | 产品名称 | 产品规格 |
| CM-SC01 | 人间充质干细胞无血清培养基 | 100mL / 500mL |
| CM-SC02 | 人间充质干细胞无血清培养基(含血替) | 500mL |
| P-CA-505 | 外泌体分离试剂盒(沉淀法) | 20Tests / 50Tests |
| P-CA-501 | 微量外泌体分离试剂盒(磁珠法) | 20Tests / 50Tests |
| P-CA-502 | 通用外泌体分离试剂盒(SEC法) | 4Tests |
| P-CA-504 | 离心柱式外泌体分离试剂盒 | 20Tests / 50Tests |
| P-CA-506 | 外泌体保存液 | 1mL |
| P-CA-503 | 通用外泌体分离试剂盒(SEC法) | 3Tests |
参考文献:
[1] Mei R, Wan Z, Yang C, et al. Advances and clinical challenges of mesenchymal stem cell therapy. Frontiers in Immunology. 2024; 15:1421854.
[2] Yang, G., Fan, X., Liu, Y. et al. Immunomodulatory Mechanisms and Therapeutic Potential of Mesenchymal Stem Cells. Stem Cell Reviews and Reports. 19, 1214-1231 (2023).
[3] Lu W, Allickson J. Mesenchymal stromal cell therapy: Progress to date and future outlook. Molecular Therapy. 2025 Jun 4; 33 (6): 2679-2688.
[4] X., Liao, R., Li, X. et al. Mesenchymal stem cells in treating human diseases: molecular mechanisms and clinical studies. Signal Transduction and Targeted Therapy. 10, 262 (2025).